高效的多肽-多肽偶联反应对于制备蛋白-药物缀合物、调控蛋白质拓扑结构、生物成像、化学生物学等领域具有重要的意义,并因其可基因编码的特性而备受关注。目前,研究报道此类连接方法并不太多见,其中分选酶(sortase)或蝶豆粘酶-1(butelase 1)介导的偶联反应具有较好的底物序列特异性,内含肽(intein)介导的蛋白质连接方法可实现可基因编码的高效主链连接,而转谷氨酰胺酶(transglutaminase)则可以介导非特异性的侧链异肽键偶联。近年来,多肽-蛋白质反应对的蓬勃发展为此类工具的发展提供了新的契机。已有谍连接酶(SpyLigase)和探连接酶(SnoopLigase)介导的多肽-多肽偶联体系见诸报道,但其效率仍有待提高,而其细胞内的应用前景仍有待探索。最近,张文彬课题组发展了独特的具有无序结构的谍订书机酶(SpyStapler),可实现谍标签(SpyTag)和北大标签(BDTag)在细胞内和细胞外的高效偶联(图1)。
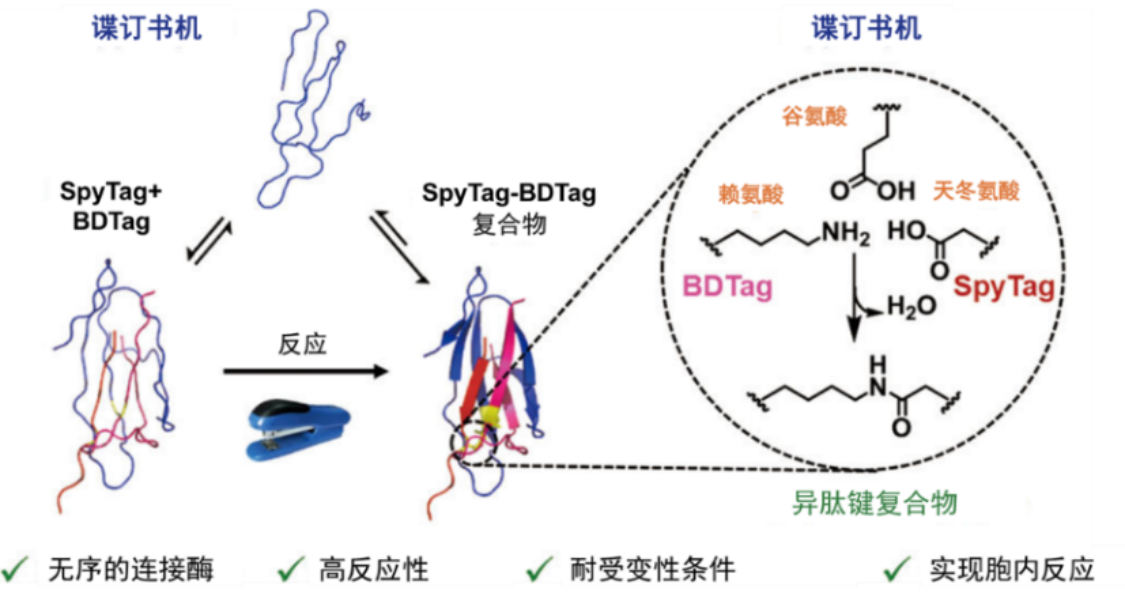
图1. 谍订书机介导的多肽-多肽偶联反应
该研究基于对谍标签-谍捕手(SpyCatcher)复合物的晶体结构分析,将谍捕手从其结构中第二个较为柔性的环区进行拆分,得到北大标签和谍订书机酶。研究表明,谍订书机酶在细胞外和细胞内环境中均可促进谍标签和北大标签之间形成异肽键,在较温和的条件下即可达到超过80 %的产率(PBS,4 oC)。该偶联方法可被用于蛋白质拓扑工程,通过细胞外反应制备四臂的星型弹性蛋白以及环状的二氢叶酸还原酶。值得注意的是,谍订书机酶在细胞内也可以高效工作,只要通过共表达线型的反应性二氢叶酸还原酶和谍订书机酶,就可以直接在细胞内原位定量实现环化(图2)。通常,酶需要稳定而有序的折叠结构以实现其功能。谍订书机酶与之形成鲜明对比。圆二色光谱和核磁共振波谱都证实谍订书机酶在溶液中完全无序,并不存在一个稳定的折叠结构。只有在谍标签和北大标签同时存在的情况下,它才能形成稳定的二级结构。也正因为它的活性不依赖于预先存在的有序结构,谍订书机酶可以耐受加热、反复冻融、化学变性等处理,而不失去其活性。谍订书机体系的高反应效率和独特的稳定性为多肽-多肽偶联以及蛋白质拓扑工程提供了新的工具。
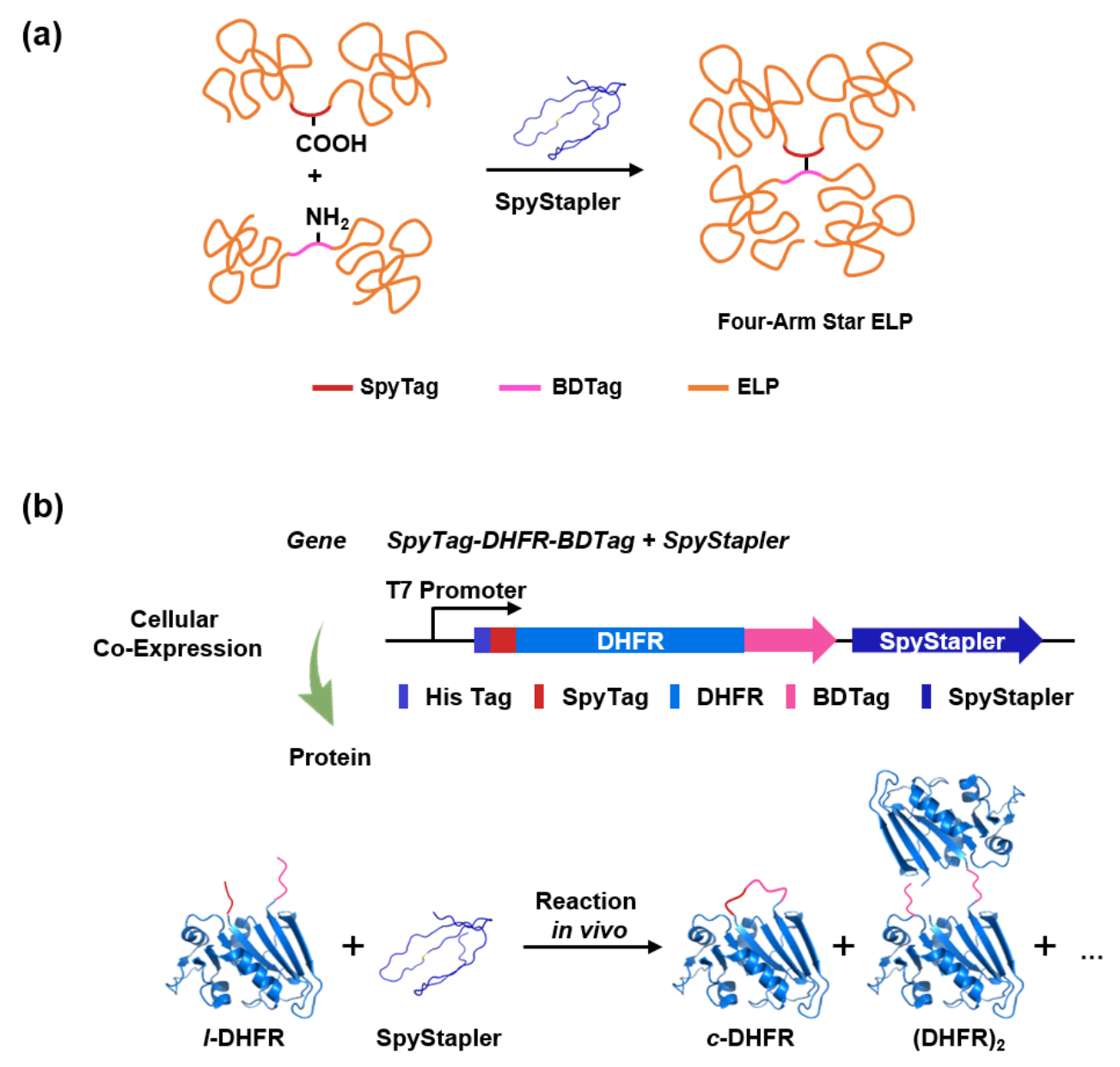
图2. (a)谍订书机酶可介导位于柔性链中的多肽标签之间的偶联,形成四臂星型弹性蛋白;(b)在细胞内共表达反应性DHFR和谍订书机酶,可实现细胞内蛋白质的原位环化。
该研究近期在线发表于Journal of the American Chemical Society(https://pubs.acs.org/doi/10.1021/jacs.8b08250)。澳门新甫京娱乐娱城平台博士生吴夏泠和刘雅杰为该论文共同第一作者,张文彬研究员为论文通讯作者。香港科技大学的孙飞教授亦参与了该研究。该工作得到国家自然科学基金、863计划、澳门新甫京娱乐娱城平台跨学科医学种子基金以及吉林大学超分子结构与材料国家重点实验室开放课题的资助。