近日,北京大学化学与分子工程学院应用化学系刘志博课题组在CCS Chemistry上发表题为“Gadolinium Neutron Capture Reaction-Induced Nucleodynamic Therapy Potentiates Antitumor Immunity”的研究论文(DOI: 10.31635/ccschem.023.202202488)。该工作利用157Gd(n, γ)反应激发 MOFs材料,在肿瘤内原位产生·OH和1O2等活性氧物种,杀伤肿瘤细胞并激活全身肿瘤免疫,为中子俘获治疗和放疗增敏提供了新思路。
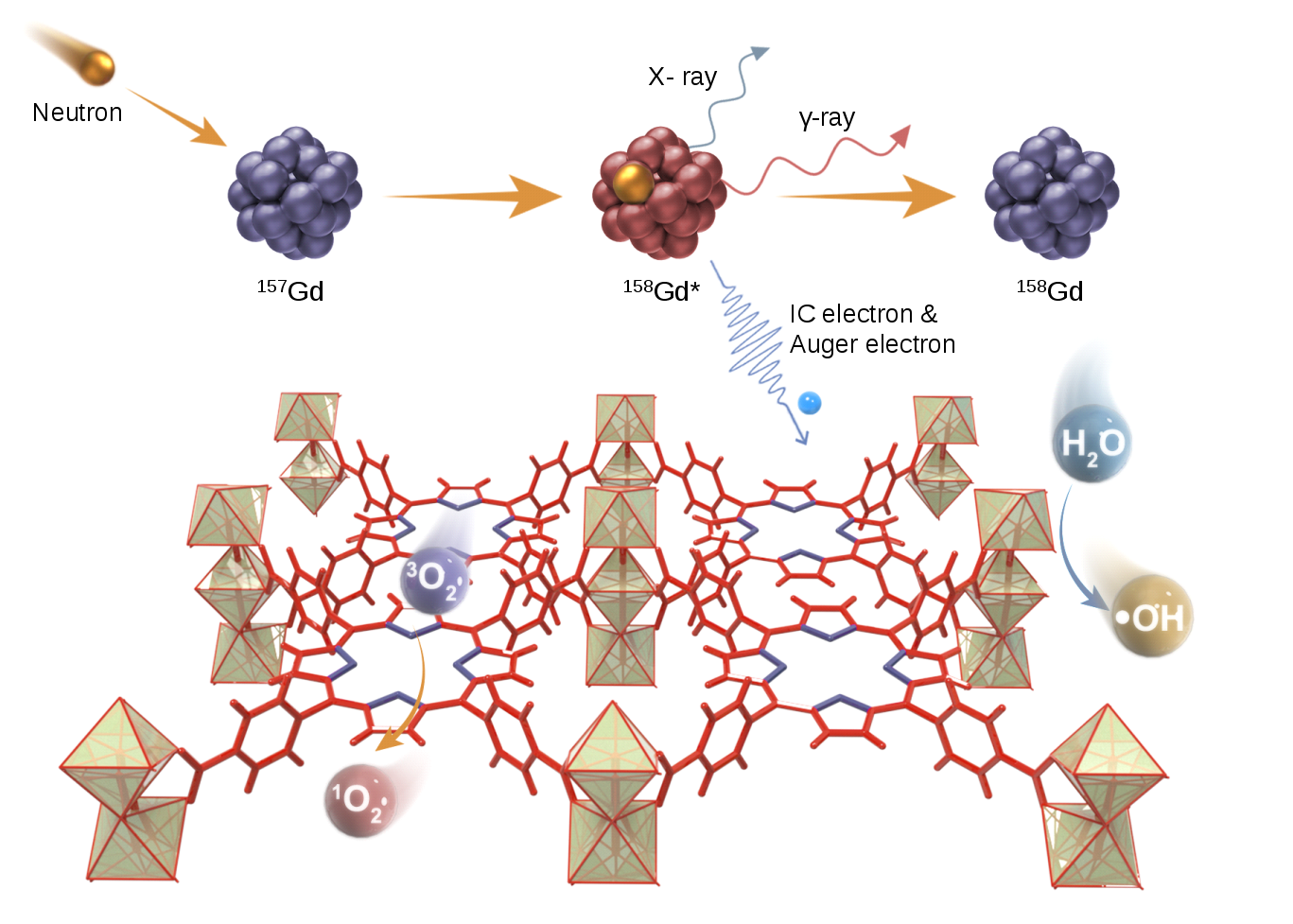
图1 钆中子俘获反应驱动的核动力治疗示意图
在活体内触发核反应是引入内源电离辐射的直接方法。中子俘获反应已被用于肿瘤的放射治疗,157Gd是热中子俘获截面最高的稳定同位素之一,基于157Gd(n, γ)反应的钆中子俘获治疗(GdNCT)在放射免疫治疗中具有较大的潜力。GdNCT通过157Gd(n, γ)反应产生俄歇电子、X射线、γ射线和内转换电子等多种电离辐射杀伤肿瘤,其中高LET的俄歇电子是GdNCT 生物学效应的主要来源。但俄歇电子射程很短(< 50 nm),需要157Gd贴近DNA才能产生显著的治疗效果,细胞杀伤力不足阻碍了GdNCT 的临床应用。
在该工作中,作者以 MOFs材料157Gd-TCPP为钆携带剂,将能量释放体157Gd与能量吸收体卟啉分子通过配位键直接相连,利用157Gd(n, γ)反应产生的俄歇电子、X射线、γ射线和内转换电子激发 MOFs材料,产生1O2和·OH等活性氧物种,杀伤肿瘤细胞并激活抗肿瘤免疫。实验和计算结果表明,俄歇电子是激发卟啉分子产生1O2的主要辐射源,而X射线和γ射线主要引起水辐解产生·OH。细胞和动物实验结果表明,·OH介导的DNA 损伤及1O2介导的脂质过氧化诱导肿瘤细胞免疫原性死亡,激活了肿瘤T 细胞的免疫反应。此外,该策略重塑了免疫抑制性肿瘤微环境,在与抗PD-L1 免疫疗法相结合后,不仅能使小鼠肿瘤模型原发和远端肿瘤几乎完全消退,还能产生全身抗肿瘤免疫,有效抑制残余肿瘤的复发和转移。综上,该策略充分提高了GdNCR核反应能量的利用率,实现了中子俘获治疗和动力治疗的协同叠加,为活体内的辐射激活及基于核反应的增强放疗带来了新的思路和解决途径。
澳门新甫京娱乐娱城平台段东斑博士、中国原子能科学研究院博士研究生韩祎、澳门新甫京娱乐娱城平台博士研究生涂智宇为该文共同第一作者,澳门新甫京娱乐娱城平台刘志博为通讯作者。北京凯佰特科技股份有限公司的刘彤总经理和张紫竹研究员对该工作亦有重要贡献。该工作得到了国家自然科学基金委、科技部、北京市重点研发专题、澳门新甫京娱乐娱城平台苏南研究院、李革-赵宁生命科学青年研究基金、昌平实验室、化学与分子工程学院、北大-清华生命科学联合中心以及澳门新甫京娱乐娱城平台分析测试中心的支持。