近日,澳门新甫京娱乐娱城平台应用化学系刘志博课题组在Nature Communications上发表了题为“Boron encapsulated in a liposome can be used for combinational neutron capture therapy”的研究论文(DOI: https://doi.org/10.1038/s41467-022-29780-w), 首次报道了一类利用硼化磷脂作为组分模拟天然脂质体结构的新型含硼脂质体(boronsome),成功用于化疗辅助的硼中子俘获治疗(boron neutron capture therapy,BNCT)。
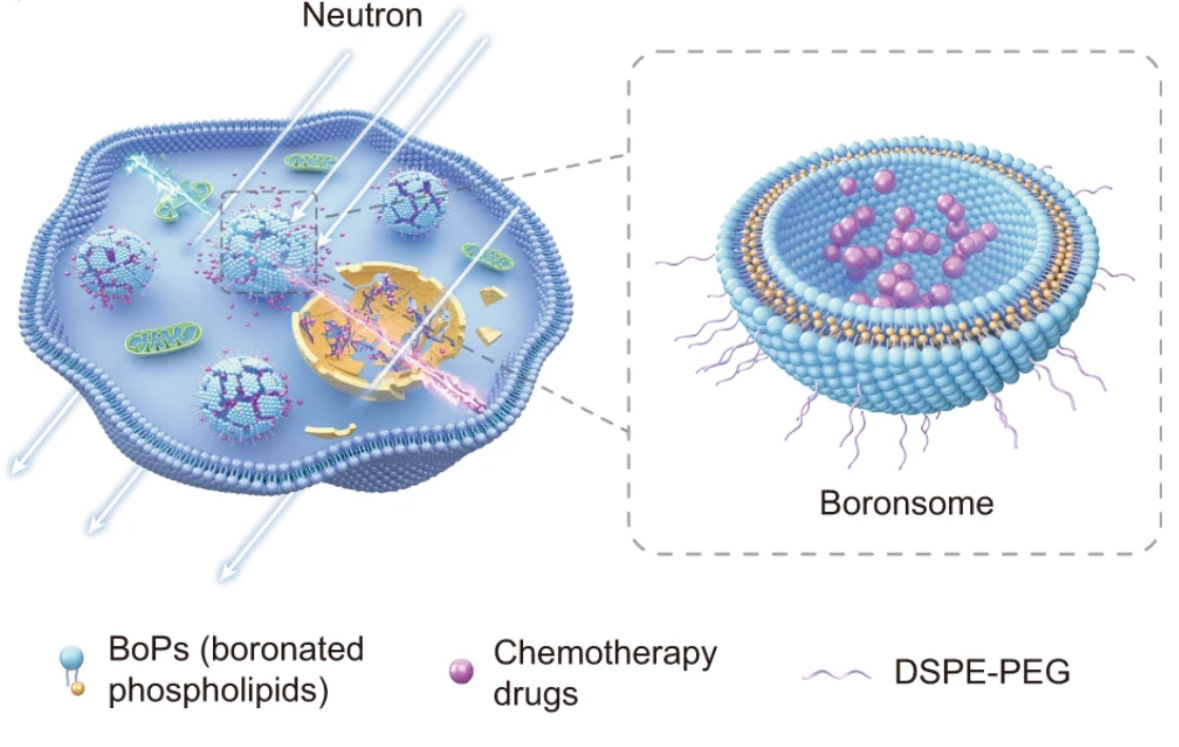
图1. Boronsome用于化疗辅助的硼中子俘获治疗
硼-10可以俘获热中子,由该中子核反应产生的α粒子会在极短的距离(5-9微米,约为人体细胞的半径)内释放出所有的能量,并杀死该细胞。这种在细胞层面上对肿瘤进行治疗的方法,被称为硼中子俘获治疗(BNCT)。作为二元放疗手段,BNCT相比单纯的放疗和化疗具有双重筛选功能,可显著提高肿瘤治疗的精准性。然而,目前BNCT缺少能够实时监测患者体内的硼浓度分布的影像手段,缺乏高效的硼递送体系,迄今只有BPA(4-硼酸苯丙氨酸)获批用于癌症治疗,但治疗效果有待提高,限制了BNCT临床推广。近年来,刘志博课题组深入研究了BNCT独特的化学效应和辐射生物学效应,发展了包括硼氨酸、碳硼烷胶束、氮化硼纳米颗粒等多种诊疗一体BNCT硼递送体系,获国际中子俘获治疗协会颁发的Fairchild Award。
在本工作中,作者将具有高稳定性、疏水性以及高含硼量的碳硼烷连接在磷脂酰胆碱的侧链上,获得的硼化磷脂结构组装形成了一类新型含硼脂质体,即boronsome。其具备良好的生物相容性和稳定性,在肿瘤内摄取高、滞留长,在肿瘤周围的正常组织中摄取较低。相比于经典硼携带剂BPA,boronsome能够将更多的硼递送至肿瘤内。同时,借助放射性标记,作者通过正电子发射断层扫描(PET)成像实现了组织硼生物分布的实时、动态、定量检测,有效地确定了最佳辐照时间。更重要的是,本工作通过将PARP1抑制剂封装到boronsome中,为BNCT 开发了靶向性同步放化疗的治疗手段,显著提高了BNCT的疗效。综上,boronsome具备良好的安全性及医学成像的能力,有突出的临床转化价值。
澳门新甫京娱乐娱城平台的李纪元博士和前沿交叉学科研究院生命科学联合中心博士研究生孙琪为该文共同第一作者,刘志博为通讯作者。北京凯佰特科技股份有限公司的刘彤总经理和张紫竹研究员对该工作亦有重要贡献。该工作得到了国家自然科学基金委、科技部、北京市重点研发专题、澳门新甫京娱乐娱城平台苏南研究院、李革-赵宁生命科学青年研究基金、昌平实验室、化学与分子工程学院以及北大-清华生命科学联合中心的资助。
原文链接:https://www.nature.com/articles/s41467-022-29780-w#Fig1