膜蛋白是细胞间相互作用的主要参与者,在细胞信号转导、分化增殖、应激响应等生命过程中都扮演着极为重要的角色。它们直接影响了包括恶性肿瘤、神经疼痛等诸多疾病的发生发展过程,是一类重要的药物靶标。然而,传统药物通过阻断膜蛋白胞外区与配体的相互作用或抑制其胞内区的活性来发挥作用,往往存在抑制不彻底或诱发耐药性的问题。新兴的蛋白质靶向降解技术(例如PROTAC)为药物开发提供了全新思路,通过特异性降解胞内靶标,直接消除了引起异常表型的蛋白质机器。这一独特的作用机制同样适用于传统意义上的不可成药的靶点,极大地拓展了其成药范围。遗憾的是,PROTAC分子的靶标大多是胞内蛋白,对膜蛋白靶向降解的探索有限。近期,基于 LYTAC和AbTAC的膜蛋白靶向降解技术分别利用细胞膜上的受体CI-M6PR或E3泛素连接酶RNF43将目标膜蛋白转运至溶酶体中降解,然而,这两种策略依赖于细胞表面特定蛋白质(受体或者酶)的表达,目前尚缺乏一种通用型的膜蛋白靶向降解技术。
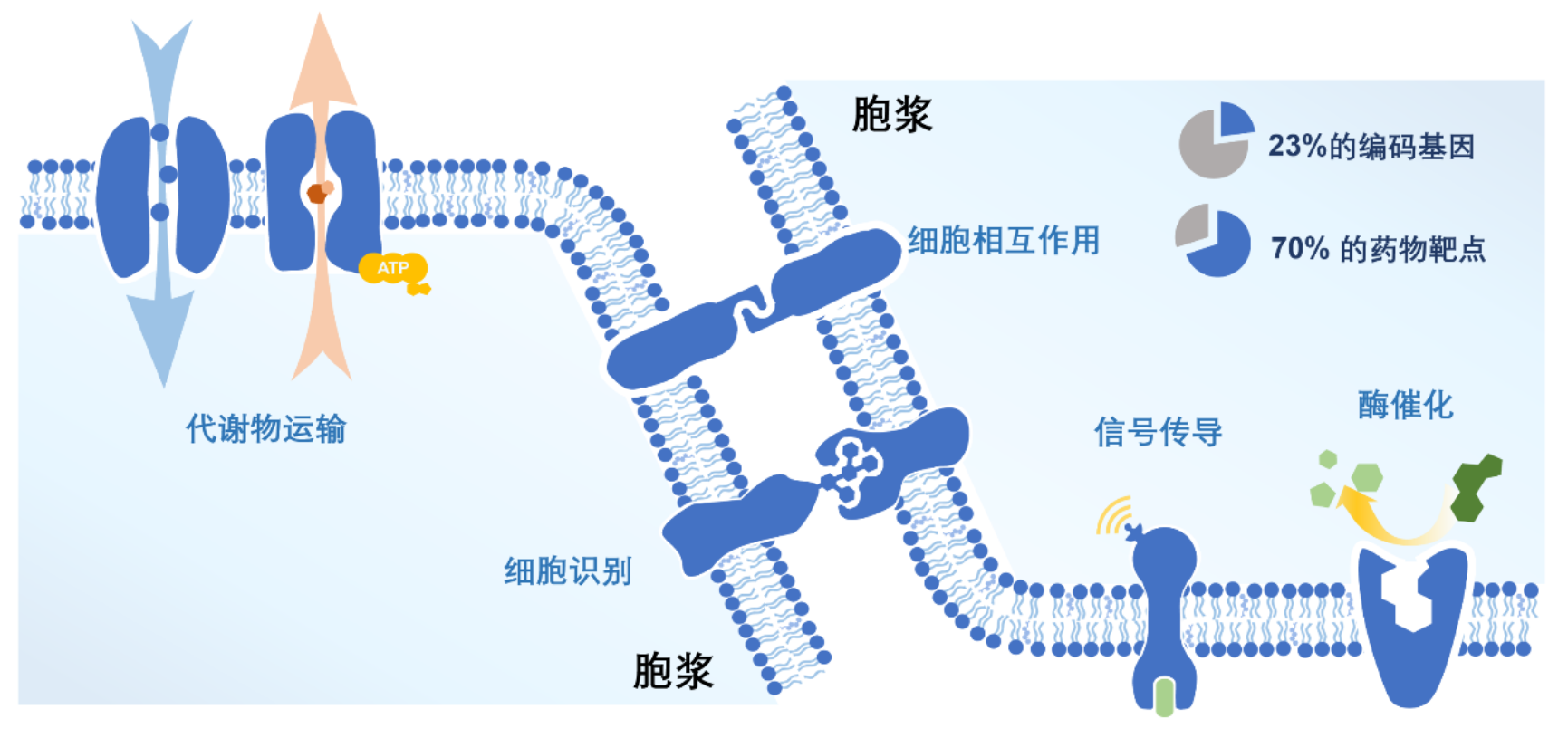
图1. 膜蛋白及其承担的主要功能
近日,澳门新甫京娱乐娱城平台化学与分子工程学院陈鹏、林坚合作团队报道了一种通用型的膜蛋白靶向降解技术(图2A)。作者首先开发了基于定量质谱的位点筛选策略(MSSP),结合遗传密码子拓展技术(GCE),得到了可以同PD-L1共价结合的“胶水抗体”,又称作GlueBody。GlueBody 的应用使得抗体、抗原间从非共价相互作用转变为共价结合,避免了膜蛋白降解子和膜蛋白复合物在内吞、降解的过程中可能发生的因解离带来的降解效率降低的问题。同时,由于单域抗体结合抗原后的内吞过程受到抗原、结合表位和所处微环境等多个因素的影响。为了加速内吞进程,作者通过酶催化反应高效地在共价抗体上添加了促进内吞和降解的细胞穿膜肽和溶酶体分选序列,最终得到膜蛋白靶向降解子——GlueTAC(图2B)。随后的实验结果表明,GlueTAC能够在包括肺癌、乳腺癌、黑色素瘤等多种癌细胞中快速介导靶蛋白PD-L1的内吞和在溶酶体中的降解。与非共价的降解嵌合体和单独的GlueBody相比,共价抗体和促进内吞靶向的功能肽对降解效率都有着极为重要的作用,二者在组合中缺一不可(图2C)。最后,作者进一步证明GlueTAC介导的PD-L1的降解能够比单纯阻断PD-1/PD-L1相互作用更为高效、持久地激活T细胞和抑制肿瘤生长(图2D, 图2E)。
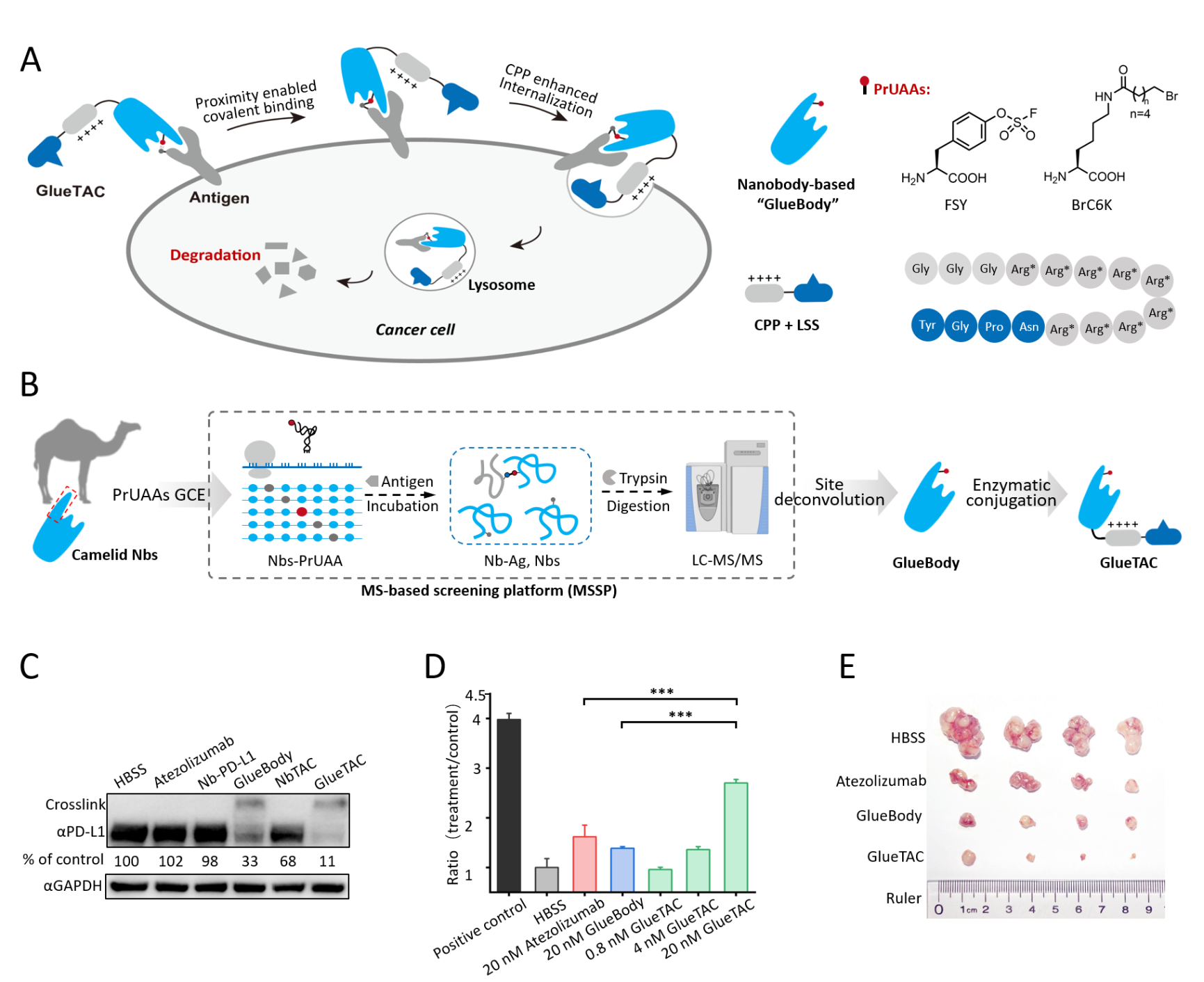
图2. GlueTAC技术用于膜蛋白靶向降解
综上,该项研究开发了基于质谱的共价单域抗体(GlueBody)筛选方法,并得到了靶向PD-L1的GlueBody,进而最终发展了具有普适性的膜蛋白降解技术GlueTAC。该技术为消除功能异常的膜蛋白提供了强有力的工具,理论上能够克服因长期用药(如肺癌治疗中以EGFR为靶点的抑制剂)带来的耐药性问题。此外,文中基于单域抗体开发的共价抗体保留了单域抗体原有组织浸润性良好的优点,同时共价结合抗原能实现更为持久的疗效而又避免了系统性暴露带来的安全性风险,为抗体药物的发展开辟了重要的方向。该研究成果近日以“Covalently Engineered Nanobody Chimeras for Targeted Membrane Protein Degradation”为题发表于Journal of the American Chemical Society(https://doi.org/10.1021/jacs.1c08521)。
澳门新甫京娱乐娱城平台博士研究生张衡、韩雨为该论文的共同第一作者,澳门新甫京娱乐娱城平台、北大-清华生命科学联合中心陈鹏教授和林坚副研究员为共同通讯作者。该工作得到了国家自然科学基金委、科技部、北京分子科学国家研究中心、深圳湾实验室以及北大-清华生命科学联合中心的资助。