近日,澳门新甫京娱乐娱城平台应用化学系刘志博课题组在德国应用化学(Angewandte Chemie)上发表了题为“Cationic Micelle as An In Vivo Catalyst for Tumor-Localized Cleavage Chemistry”的研究论文(DOI: 10.1002/anie.202106526)。与经典活体化学调控策略不同,刘志博课题组通过引入阳离子胶束作为“活体催化剂”,选择性地上调了肿瘤内脱硅反应的速率常数,从一个全新的角度调控了活体剪切化学。
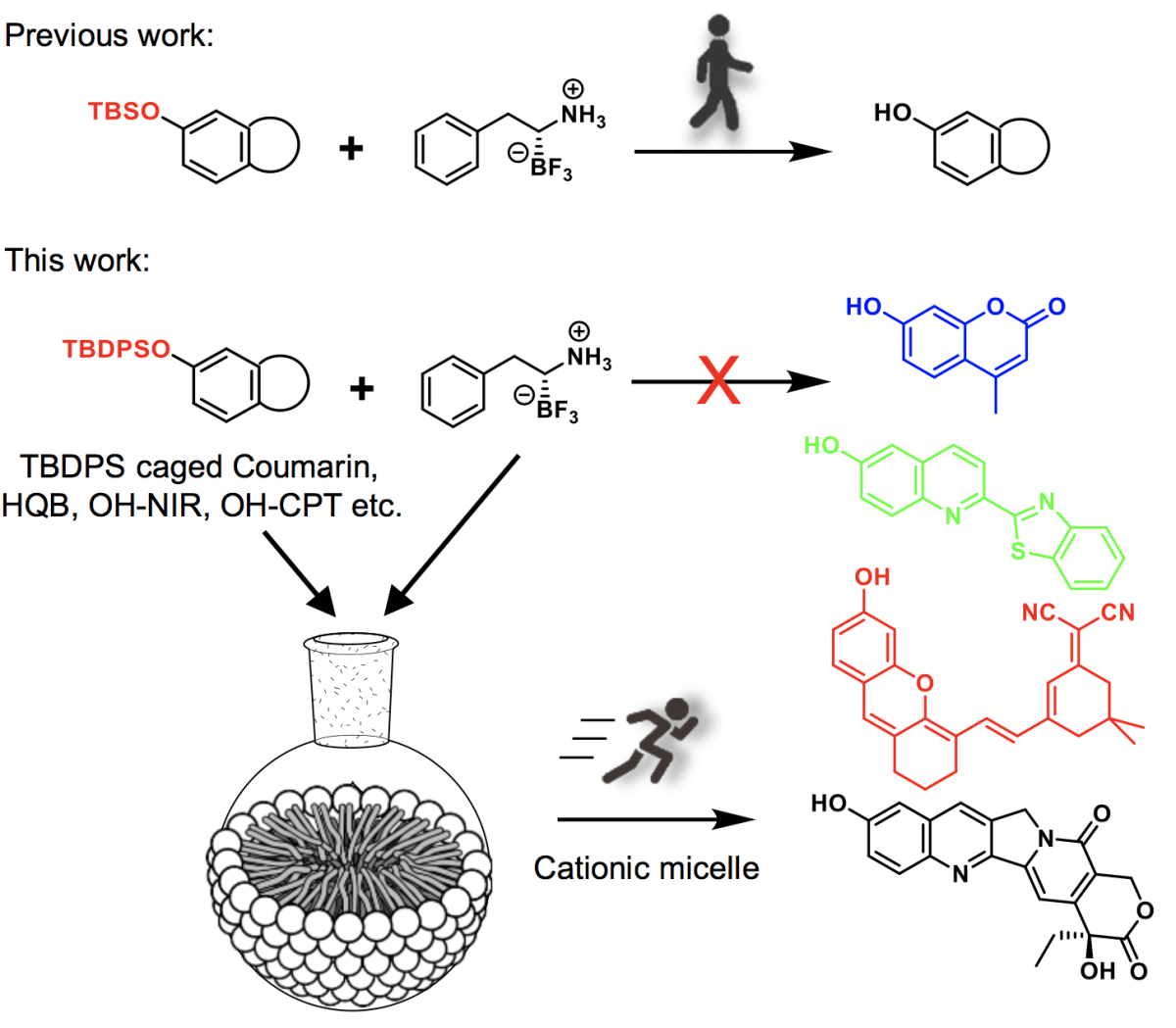
图1. 阳离子胶束催化硼氨酸介导的脱硅剪切化学
很多重要的活体化学是二级反应,其反应速率取决于速率常数以及两反应物的浓度。因此,借助反应物的靶向性实现其在特定组织的富集,进而提高其局域浓度,是调控活体化学、实现可控释放的重要手段。然而,受限于反应物的组织选择性,该策略的应用难以拓展。
受放射化学领域中放射性离子与相关材料吸附机制的启发,刘志博团队发现通常用于mRNA药物的阳离子胶束可作为催化剂,加速其近期发展的活体脱硅反应(Nature, 2020, 579, 421-426;J. Am. Chem. Soc., 2021,143, 2250-2255)。该胶束催化可将脱硅速率常数提高1400余倍,且在试管、活细胞及动物模型上都可高效进行,进而实现了肿瘤内药物的可控释放。机理研究表明,其催化能力来自于“胶束效应”,而正电荷密度更高的阳离子多聚物如聚乙烯亚胺(PEI)由于缺少疏水部分,无法形成胶束,不具备催化加速的能力。
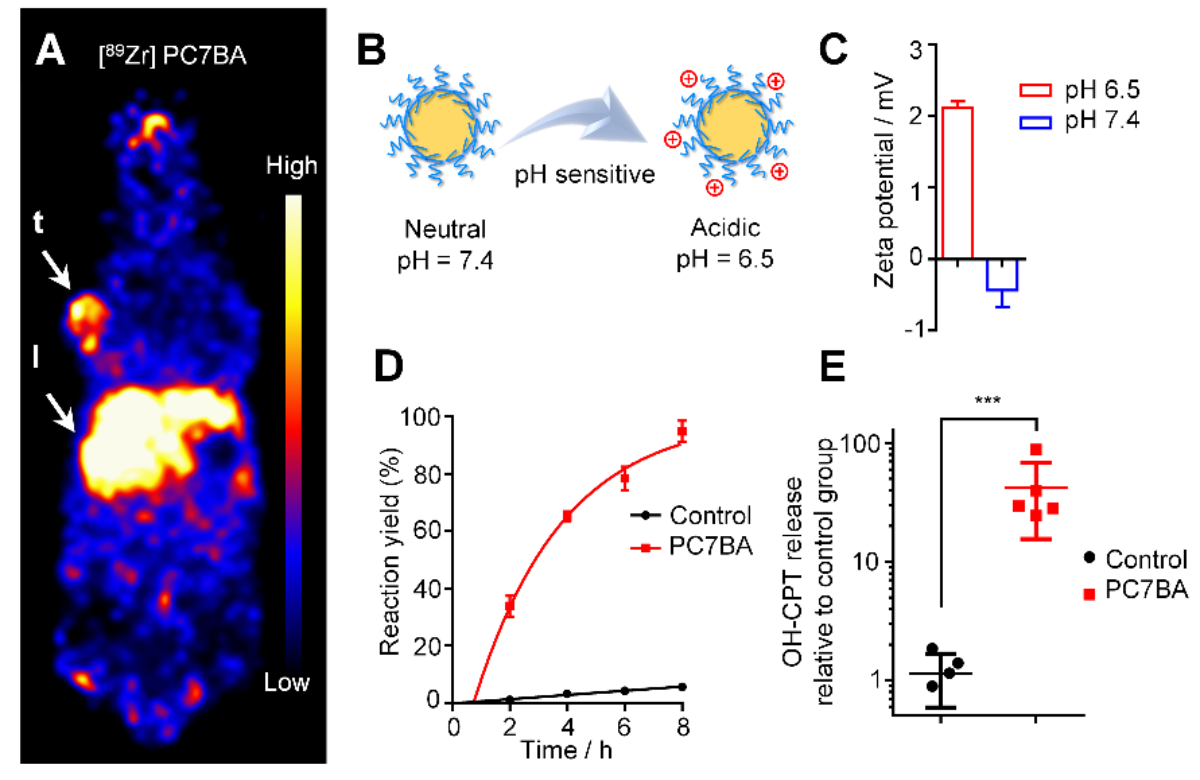
图2.响应微酸体系的新型胶束(PC7BA)用于肿瘤选择性地加速活体脱硅反应
考虑到阳离子胶束在体内循环中会被快速清除,传统的阳离子胶束无法实现尾静脉给药。因此,作者构建了一类对微酸性环境响应的新型胶束体系。该胶束在血液循环中为弱负电性。到达肿瘤部位后,其可以响应肿瘤的微酸环境实现电荷翻转,在肿瘤处原位转化为阳离子胶束。该策略被应用于羟基喜树碱前药的肿瘤选择性激活,其效率是对照组的42倍。该工作揭示了阳离子胶束的一个新功能,即可以作为催化剂调控活体化学反应。作为一个经典药物递送体系,该发现有望用于发展全新的药物递送及控释策略,有较强的临床应用前景。
澳门新甫京娱乐娱城平台的博士研究生王春洪为该文的第一作者,刘志博研究员为通讯作者。澳门新甫京娱乐娱城平台李子臣教授亦为该工作做出了重要的贡献。该工作得到了北京市重点研发专题、国家自然科学基金委、科技部、澳门新甫京娱乐娱城平台基础加强项目、北京分子科学国家研究中心以及北大-清华生命科学联合中心的资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202106526